Un outil d'IA efficace pour la segmentation de tumeurs pulmonaires en TDM
MERCREDI 22 JANVIER 2025 Soyez le premier à réagir
Soyez le premier à réagirUn nouveau modèle de deep learning s’avère prometteur dans la détection et la segmentation des tumeurs pulmonaires, selon une étude publiée dans la Revue Radiology. Les résultats de l’étude pourraient avoir des implications importantes pour le traitement du cancer du poumon dans un avenir proche.

La détection et la segmentation précises des tumeurs pulmonaires à partir de la tomodensitométrie (TDM) sont essentielles pour surveiller la progression du cancer, évaluer les réponses au traitement et planifier la radiothérapie. Actuellement, les cliniciens expérimentés identifient et segmentent manuellement les tumeurs pulmonaires sur des images médicales, un processus chronophage et soumis à la variabilité des médecins.
Un modèle de deep learning entrainé pour détecter et segmenter les tumeurs pulmonaires à partie de la TDM
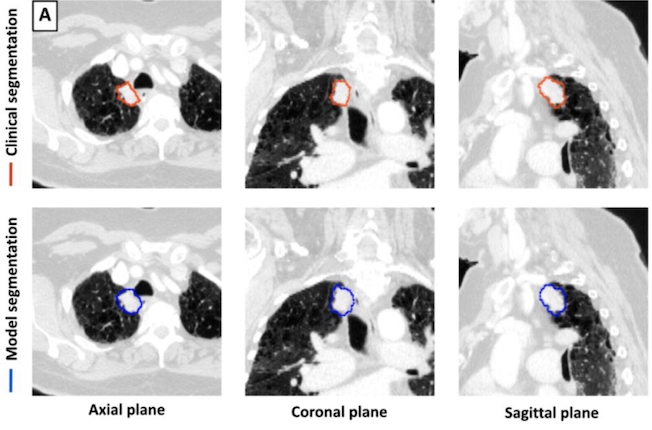 Bien que des méthodes de deep learning aient été appliquées à la détection et à la segmentation des tumeurs pulmonaires, les études antérieures ont été limitées par de petits ensembles de données, une dépendance aux entrées manuelles et une concentration sur la segmentation de tumeurs pulmonaires uniques, soulignant la nécessité de modèles robustes et automatisés capables de détecter et de segmenter les tumeurs de manière dans divers contextes cliniques.
Bien que des méthodes de deep learning aient été appliquées à la détection et à la segmentation des tumeurs pulmonaires, les études antérieures ont été limitées par de petits ensembles de données, une dépendance aux entrées manuelles et une concentration sur la segmentation de tumeurs pulmonaires uniques, soulignant la nécessité de modèles robustes et automatisés capables de détecter et de segmenter les tumeurs de manière dans divers contextes cliniques.
Dans une étude publiée dans la Revue Radiology, un ensemble de données uniques à grande échelle composé de TDM de simulation pré-radiothérapie collectées en routine et de leurs segmentations cliniques 3D associées a été utilisé pour développer un modèle de détection et de segmentation de tumeurs pulmonaires de niveau quasi expert. L’objectif principal était de développer un modèle capable d’identifier et de segmenter avec précision les tumeurs pulmonaires sur les TDM provenant de différents centres médicaux.
Un modèle élaboré à partir de plus de 1 500 TDM pulmonaires
« À notre connaissance, notre ensemble de données de formation est la plus grande collection de TDM et de segmentations de tumeurs cliniques rapportée dans la littérature pour la construction d'un modèle de détection et de segmentation de tumeurs pulmonaires », précise l'auteur principal de l'étude, le Dr Mehr Kashyap, du département de médecine de la faculté de l'université de Stanford (Californie – USA).
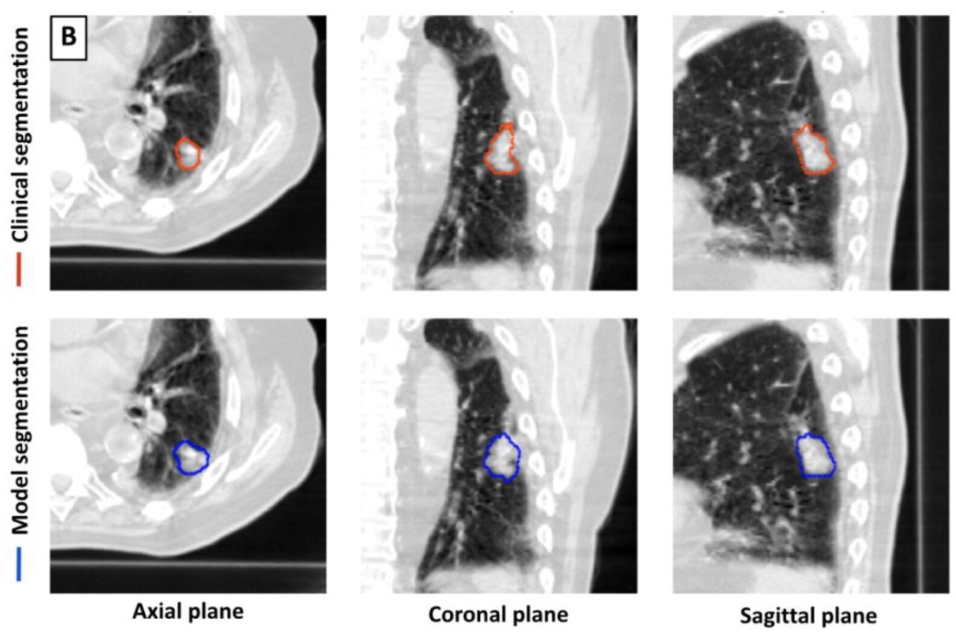 Pour ce travail rétrospectif, un modèle de deep learning 3D U-Net a été formé pour la détection et la segmentation des tumeurs pulmonaires à l'aide de 1 504 TDM avec 1 828 tumeurs pulmonaires segmentées. Le modèle a ensuite été testé sur 150 TDM. Les volumes tumoraux identifiés par le modèle ont été comparés aux volumes délimités par le médecin. Les mesures de performance comprenaient la sensibilité, la spécificité, le taux de faux positifs et le coefficient de similarité de Dice (DSC).
Pour ce travail rétrospectif, un modèle de deep learning 3D U-Net a été formé pour la détection et la segmentation des tumeurs pulmonaires à l'aide de 1 504 TDM avec 1 828 tumeurs pulmonaires segmentées. Le modèle a ensuite été testé sur 150 TDM. Les volumes tumoraux identifiés par le modèle ont été comparés aux volumes délimités par le médecin. Les mesures de performance comprenaient la sensibilité, la spécificité, le taux de faux positifs et le coefficient de similarité de Dice (DSC).
Des performances intéressantes du modèle considéré pour la segmentation tumorale
Le DSC calcule la similarité entre deux ensembles de données en comparant le chevauchement entre eux. Une valeur de 0 ne représente aucun chevauchement tandis qu'une valeur de 1 représente un chevauchement parfait. Les segmentations du modèle ont été comparées à celles des trois segmentations de médecins pour générer les valeurs DSC modèle-médecin pour chaque appariement. Le modèle a atteint une sensibilité de 92 % (92/100) et une spécificité de 82 % (41/50) dans la détection des tumeurs pulmonaires sur l'ensemble de examens combinés des 150 TDM.
 Pour un sous-ensemble de 100 TDM avec une seule tumeur pulmonaire chacun, les DSC médians de segmentation modèle-médecin et médecin-médecin étaient respectivement de 0,77 et 0,80. Le temps de segmentation était plus court pour le modèle que pour les médecins. Le Dr Kashyap estime que l’utilisation d’une architecture U-Net 3D dans le développement du modèle offre un avantage par rapport aux approches utilisant une architecture 2D.
Pour un sous-ensemble de 100 TDM avec une seule tumeur pulmonaire chacun, les DSC médians de segmentation modèle-médecin et médecin-médecin étaient respectivement de 0,77 et 0,80. Le temps de segmentation était plus court pour le modèle que pour les médecins. Le Dr Kashyap estime que l’utilisation d’une architecture U-Net 3D dans le développement du modèle offre un avantage par rapport aux approches utilisant une architecture 2D.
Un outil à affiner notamment en présence de grosses tumeurs
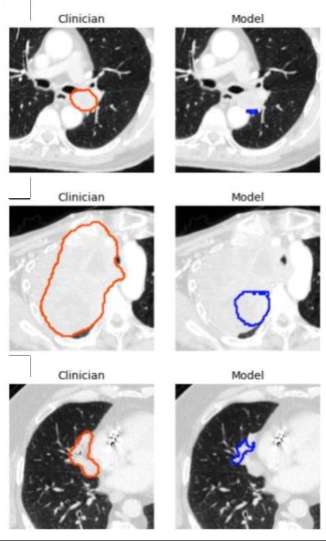 « En capturant de riches informations inter-coupes, notre modèle 3D est théoriquement capable d'identifier des lésions plus petites que les modèles 2D qui sont incapables de distinguer des structures telles que les vaisseaux sanguins et les voies respiratoires », ajoute-t-il. L’une des limites du modèle était sa tendance à sous-estimer le volume de la tumeur, ce qui entraînait de moins bonnes performances sur les très grosses tumeurs. C'est pour cela que le Dr. Kashyap prévient que le modèle doit être mis en œuvre dans un flux de travail supervisé par un médecin, permettant aux cliniciens d'identifier et d'éliminer les lésions mal identifiées et les segmentations de moindre qualité.
« En capturant de riches informations inter-coupes, notre modèle 3D est théoriquement capable d'identifier des lésions plus petites que les modèles 2D qui sont incapables de distinguer des structures telles que les vaisseaux sanguins et les voies respiratoires », ajoute-t-il. L’une des limites du modèle était sa tendance à sous-estimer le volume de la tumeur, ce qui entraînait de moins bonnes performances sur les très grosses tumeurs. C'est pour cela que le Dr. Kashyap prévient que le modèle doit être mis en œuvre dans un flux de travail supervisé par un médecin, permettant aux cliniciens d'identifier et d'éliminer les lésions mal identifiées et les segmentations de moindre qualité.
Une nouvelle approche qui piourrait avoir de nombreuses implications cliniques à l’avenir
Les chercheurs suggèrent d’autre part que les recherches futures devraient se concentrer sur l’application du modèle pour estimer la charge tumorale pulmonaire totale et évaluer la réponse au traitement au fil du temps, en la comparant aux méthodes existantes. Ils recommandent également d’évaluer la capacité du modèle à prédire les résultats cliniques sur la base de la charge tumorale estimée, en particulier lorsqu’il est combiné à d’autres modèles pronostiques utilisant diverses données cliniques.
« Notre étude représente une étape importante vers l’automatisation de l’identification et de la segmentation des tumeurs pulmonaires, conclut le Dr. Kashyap a déclaré. Cette approche pourrait avoir de vastes implications, notamment son intégration dans la planification automatisée des traitements, la quantification de la charge tumorale, l’évaluation de la réponse au traitement et d’autres applications radiomiques. »
Bruno Benque
