Détecter précocement la maladie d'Alzheimer grâce au Deep Learning des données de PET-FDG
MARDI 06 NOVEMBRE 2018 Soyez le premier à réagir
Soyez le premier à réagirLe Deep Learning basé sur les données du PET-FDG améliorerait la capacité de l'imagerie cérébrale à prédire précocement la maladie d'Alzheimer. C'est ce que conclut une étude publiée dans la revue Radiology qui identifie les changements métaboliques avec une sensibilité significative.

Le diagnostic précoce de la maladie d'Alzheimer est extrêmement important, les traitements s'avérant plus efficaces au début de l'évolution de la maladie.
Des changements métaboliques difficiles à évaluer au stade précoce
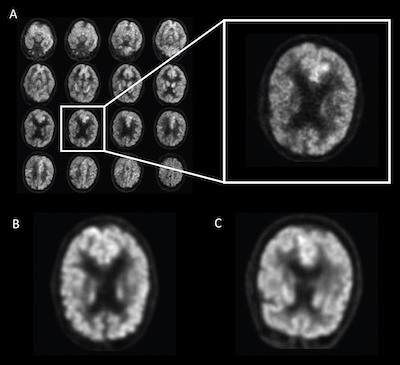 La recherche a établi, en effet, un lien entre l'évolution de la maladie et les modifications du métabolisme, comme en témoigne l'absorption de glucose dans certaines régions du cerveau, mais ces modifications peuvent être difficiles à identifier. C'est dans ce cadre qu'une étude, publiée dans la revue Radiology, a tenté d'évaluer les apports de l'Intelligence Artificielle (IA) dans la capacité de l'imagerie cérébrale à prédire cette maladie. "Les différences d'absorption de glucose dans le cerveau sont très subtiles et diffuses, commente le Dr Jae Ho Sohn, co-auteur de l'étude, du département de radiologie et d'imagerie biomédicale de l'Université de Californie à San Francisco (UCSF). L'identification des biomarqueurs spécifiques de la maladie est facile, mais les changements métaboliques représentent un processus plus global et subtil."
La recherche a établi, en effet, un lien entre l'évolution de la maladie et les modifications du métabolisme, comme en témoigne l'absorption de glucose dans certaines régions du cerveau, mais ces modifications peuvent être difficiles à identifier. C'est dans ce cadre qu'une étude, publiée dans la revue Radiology, a tenté d'évaluer les apports de l'Intelligence Artificielle (IA) dans la capacité de l'imagerie cérébrale à prédire cette maladie. "Les différences d'absorption de glucose dans le cerveau sont très subtiles et diffuses, commente le Dr Jae Ho Sohn, co-auteur de l'étude, du département de radiologie et d'imagerie biomédicale de l'Université de Californie à San Francisco (UCSF). L'identification des biomarqueurs spécifiques de la maladie est facile, mais les changements métaboliques représentent un processus plus global et subtil."
Création d'un algorithme basé sur les données du PET-FDG
Le Dr Benjamin Franc, auteur principal de l'étude, de l'UCSF, a contacté le Dr Sohn et l'Université de Californie à Berkeley, par l'intermédiaire du groupe de recherche Big Data in Radiology (BDRAD), une équipe multidisciplinaire de médecins et d'ingénieurs travaillant dans le domaine  des datas de radiologie. Il souhaitait envisager avec eux l'utilisation du Deep Learning afin de détecter les modifications du métabolisme cérébral prédictives de la maladie d’Alzheimer. Les chercheurs ont ainsi créé un algorithme sur la base d'un PET au 18-F-fluorodésoxyglucose (PET-FDG). Dans ce type d'examen, le FDG, est injecté dans le sang et la TEP peut ensuite mesurer l'absorption de FDG dans les cellules du cerveau, ce qui fait office d'indicateur de l'activité métabolique.
des datas de radiologie. Il souhaitait envisager avec eux l'utilisation du Deep Learning afin de détecter les modifications du métabolisme cérébral prédictives de la maladie d’Alzheimer. Les chercheurs ont ainsi créé un algorithme sur la base d'un PET au 18-F-fluorodésoxyglucose (PET-FDG). Dans ce type d'examen, le FDG, est injecté dans le sang et la TEP peut ensuite mesurer l'absorption de FDG dans les cellules du cerveau, ce qui fait office d'indicateur de l'activité métabolique.
Le Deep Learning identifie les schémas métaboliques avec une sensibilité significative
Les chercheurs ont eu accès aux données de l'Alzheimer’s Disease Neuroimaging Initiative (ADNI), une vaste étude multi-site axée sur les essais cliniques visant à améliorer la prévention et le traitement de cette maladie. L'ensemble de données ADNI comprenait plus de 2 100 images cérébrales de PET-FDG provenant de 1 002 patients. Les chercheurs ont formé l'algorithme de Deep Learning sur 90% des données, puis l'ont testé sur les 10% restants. Grâce au Deep Learning, l'algorithme a pu apprendre lui-même les schémas métaboliques correspondant à la maladie d'Alzheimer. Enfin, les chercheurs ont testé l'algorithme sur un ensemble indépendant de 40 examens d'imagerie de 40 patients qu'il n'avait jamais étudiés. L'algorithme a atteint une sensibilité de 100% lors de la détection de la maladie, en moyenne plus de six ans avant le diagnostic final.
Un outil complémentaire au travail des radiologues
 "Nous sommes très satisfaits de la performance de cet algorithme, s'exclame le Dr Sohn. Il a été possible de prédire chaque cas ayant évolué vers la maladie d'Alzheimer." Bien qu'il reconnaisse que cette procédure indépendante nécessite une étude prospective multi-sites plus poussée, le Dr Sohn remarque que cet algorithme peut être un excellent outil complémentaire pour le travail des radiologues, en plus des éléments biochimiques et des images médicales, ainsi qu'une opportunité pour appliquer des traitements précoces de l'Alzheimer. "Si nous diagnostiquons la maladie d'Alzheimer lorsque tous les symptômes se sont manifestés, le volume du cerveau est tellement important qu'il est trop tard pour intervenir, poursuit-il. Si nous pouvons le détecter plus tôt, les chercheurs auront ainsi la possibilité de trouver des moyens de ralentir, voire d'arrêter, le processus de la maladie."
"Nous sommes très satisfaits de la performance de cet algorithme, s'exclame le Dr Sohn. Il a été possible de prédire chaque cas ayant évolué vers la maladie d'Alzheimer." Bien qu'il reconnaisse que cette procédure indépendante nécessite une étude prospective multi-sites plus poussée, le Dr Sohn remarque que cet algorithme peut être un excellent outil complémentaire pour le travail des radiologues, en plus des éléments biochimiques et des images médicales, ainsi qu'une opportunité pour appliquer des traitements précoces de l'Alzheimer. "Si nous diagnostiquons la maladie d'Alzheimer lorsque tous les symptômes se sont manifestés, le volume du cerveau est tellement important qu'il est trop tard pour intervenir, poursuit-il. Si nous pouvons le détecter plus tôt, les chercheurs auront ainsi la possibilité de trouver des moyens de ralentir, voire d'arrêter, le processus de la maladie."
Des recherches futures sur les agrégats protéiques, marqueurs spécifiques de l'Alzhzimer
Les prochaines recherches porteront notamment sur la formation d'un algorithme de Deep Learning visant à rechercher des schémas associés à l'accumulation de protéines bêta-amyloïdes et tau, d'agrégats protéiques anormaux dans le cerveau, qui sont des marqueurs spécifiques de la maladie d'Alzheimer, selon le Dr Youngho Seo, de l'UCSF, qui a été l’un des conseillers pédagogiques de l’étude. "Si le PET-FDG peut prédire la maladie d'Alzheimer avec l'IA, l'imagerie TEP de la protéine bêta-amyloïde et de la protéine tau, à un stade précoce, peut éventuellement ajouter une autre dimension au pouvoir prédictif de l'IA", conclut-il.
Bruno Benque avec RSNA
