Adapter le Segment ANything Model pour l'exploration des hématomes intracrâniens par TDM
LUNDI 02 JUIN 2025 Soyez le premier à réagir
Soyez le premier à réagirLe deep learning est cité en référence pour améliorer l’identification et le volume des hématomes cérébraux. Mais le Segment Anything Model peut gérer les contours complexes ou le faible contraste. Une étude publiée dans la Revue European Radiology expérimente une combinaison du SAM et de paramètres spéciaux pour optimiser l’analyse des hématomes intracérébraux. Ses performances semblent alignées avec les observations des experts humains.

En présence d’un traumatisme crânien (TC), il est essentiel d’identifier le type et le volume des hématomes pour prédire son évolution car une prise en charge tardive peut entraîner une augmentation de la pression intracrânienne, des déficits neurologiques, une perte de connaissance, voire le décès. Une évaluation et une intervention efficaces pendant les « heures clés » suivant le traumatisme sont cruciales, mais difficiles.
Améliorer l’identification et le volume des hématomes cérébraux grâce au deep learning
La tomodensitométrie (TDM) est la référence absolue pour l'évaluation des TC, notamment pour la détection et l'évaluation des hématomes en situation d'urgence. Mais l'analyse manuelle des images TDM par les radiologues peut être chronophage, exigeante en ressources humaines et sujette à une variabilité inter-observateur. Dans ce cadre, des systèmes automatisés pourraient standardiser la prise en charge des TC, réduire les erreurs humaines, accélérer la prise de décision et adapter les traitements aux profils individuels des patients.
Le deep learning entre alors en jeu, les réseaux de neurones convolutifs (CNN) étant largement utilisés en raison de leurs puissantes capacités d'extraction de caractéristiques. Des architectures telles qu'U-Net et ses variantes sont devenues populaires pour les tâches de segmentation d'images médicales, la structure encodeur-décodeur d'U-Net permettant une localisation et une délimitation précises des hématomes. La combinaison des CNN avec d'autres techniques de vision par ordinateur a été étudiée pour améliorer les performances de segmentation. Ces modèles hybrides exploitent les atouts de différentes approches pour améliorer la robustesse et la précision.
Le Segment Anything Model pour gérer les contours complexes ou le faible contraste
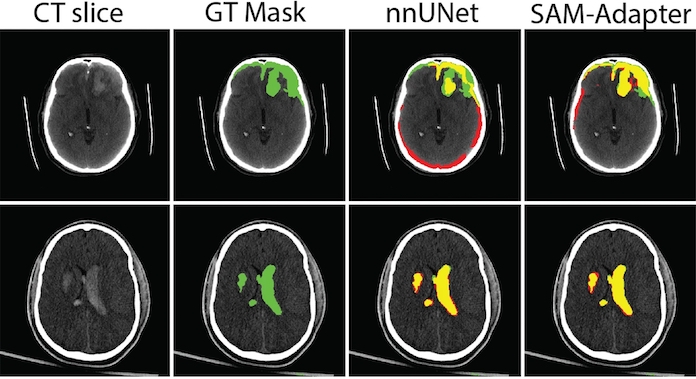 Ainsi, le passage des CNN 2D aux CNN 3D a permis une meilleure utilisation des informations volumétriques inhérentes aux TDM. Les réseaux 3D capturent plus efficacement les relations spatiales et améliorent la segmentation de structures complexes comme les hématomes. Le Segment Anything Model (SAM) a révolutionné la vision par ordinateur, notamment en segmentation d'images, en démontrant une généralisation robuste sans échantillonnage et en gérant diverses tâches de segmentation d'objets. Le SAM surpasse les modèles conventionnels, qui peinent à gérer les contours complexes ou le faible contraste, grâce à des techniques avancées de transformation de la vision et des invites simples telles que des points, des boîtes et des masques grossiers.
Ainsi, le passage des CNN 2D aux CNN 3D a permis une meilleure utilisation des informations volumétriques inhérentes aux TDM. Les réseaux 3D capturent plus efficacement les relations spatiales et améliorent la segmentation de structures complexes comme les hématomes. Le Segment Anything Model (SAM) a révolutionné la vision par ordinateur, notamment en segmentation d'images, en démontrant une généralisation robuste sans échantillonnage et en gérant diverses tâches de segmentation d'objets. Le SAM surpasse les modèles conventionnels, qui peinent à gérer les contours complexes ou le faible contraste, grâce à des techniques avancées de transformation de la vision et des invites simples telles que des points, des boîtes et des masques grossiers.
Cette innovation suscite un vif intérêt dans la segmentation d'images médicales, où le SAM est adapté à diverses applications. Les paramètres SAM affinent les informations grâce à de vastes ensembles de données d'images médicales, intégrant de multiples tâches de segmentation dans un cadre unifié. C’est le cas d’un apprentissage par transfert optimisé par le réglage des adaptateurs, qui consiste à insérer des modules d'adaptateur dans des blocs transformateurs et à mettre à jour uniquement les adaptateurs pendant l'apprentissage, tout en conservant partiellement les paramètres d'origine.
Une combinaison du SAM et de paramètres spéciaux pour optimiser l’analyse des hématomes intracérébraux
Une étude publiée dans la Revue European Radiology propose d'adapter efficacement le cadre SAM et le réglage fin optimisé par paramètres pour la segmentation des hématomes dans les lésions cérébrales traumatiques. Ce protocole expérimental comprend l'optimisation des fonctions de perte, en équilibrant spécifiquement l'entropie croisée binaire et la perte de frontière, et l'évaluation de la dimension du bloc adaptateur. Les chercheurs ont intégré les annotations de plusieurs évaluateurs afin de démontrer la généralisation et la robustesse du modèle.
Ils ont d’autre part exploré les effets du pré-apprentissage du modèle avec des ensembles de données publiques. Ces approches ont permis d'obtenir des scores d'évaluation supérieurs, améliorant la mesure automatique du volume de l'hématome et accélérant le processus de diagnostic des lésions cérébrales traumatiques.
Des performances alignées avec les observations des experts humains
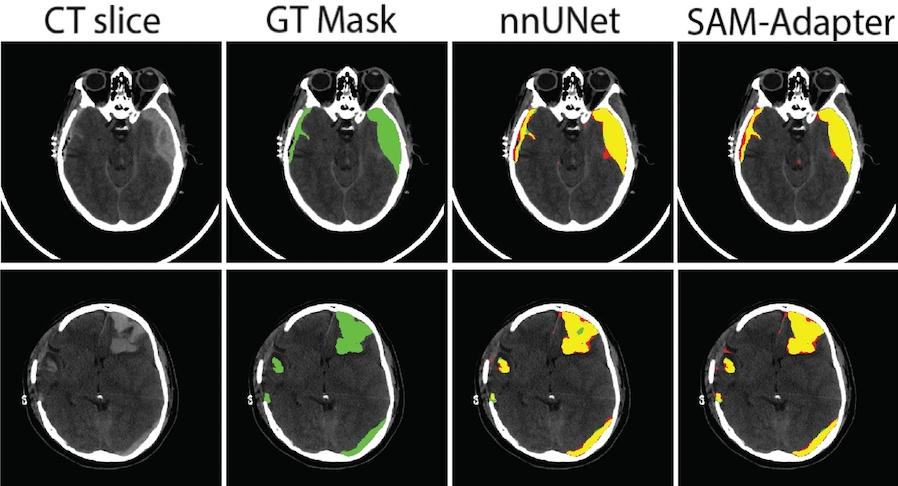 En intégrant l'adaptateur au modèle SAM standard, ils améliorent les performances du modèle et constatent qu'un prétraitement spécifique au domaine, tel que l'ajustement du contraste, réduit le besoin d'un pré-entraînement approfondi, rationalisant ainsi le modèle. De plus, les performances du modèle ont bénéficié de l'optimisation et du réglage des hyperparamètres. D’autre part, la variabilité inter-observateur a été évaluée, révélant que les performances du modèle Dice (67,20 %) étaient étroitement alignées avec l'accord des experts humains Dice (63,79 %), suggérant son utilité clinique potentielle.
En intégrant l'adaptateur au modèle SAM standard, ils améliorent les performances du modèle et constatent qu'un prétraitement spécifique au domaine, tel que l'ajustement du contraste, réduit le besoin d'un pré-entraînement approfondi, rationalisant ainsi le modèle. De plus, les performances du modèle ont bénéficié de l'optimisation et du réglage des hyperparamètres. D’autre part, la variabilité inter-observateur a été évaluée, révélant que les performances du modèle Dice (67,20 %) étaient étroitement alignées avec l'accord des experts humains Dice (63,79 %), suggérant son utilité clinique potentielle.
La validation externe sur l'ensemble de données HemSeg-200, qui contient 222 TDM, démontre la robustesse de cette approche dans divers cas. Ces avancées en matière de segmentation automatique sont prometteuses pour améliorer la précision et l'efficacité du diagnostic des lésions cérébrales traumatiques, soutenir la prise de décision clinique et améliorer les résultats pour les patients.
Paco Carmine
