Primovist est enfin autorisé sur le marché français
Plusieurs années après le début de son utilisation à l’étranger, et quelques mois après son autorisation en milieu hospitalier en France, Primovist vient d’être mis sur le marché français. Ce produit de contraste pour l’IRM à usage diagnostique a la particularité d’être hépatospécifique.
Bayer vient d’annoncer la mise sur le marché de Primovist® (acide gadoxétique) en France, un produit de contraste hépatospécifique administré par I.V. et à usage diagnostique uniquement, pour les examens d’IRM.
Cette molécule est indiquée pour la détection de lésions hépatiques focales et sur leur nature en IRM pondérée en T1 et lorsque le diagnostic ne peut être obtenu au moyen d’une IRM produit de contraste, et lorsqu’une imagerie en phase retardée est nécessaire.
Primovist® permet une détection plus précise des petits carcinomes hépatocellulaires (CHC) et des métastases hépatiques et améliore la caractérisation de certaines lésions - bénin vs. Malin ; hyperplasie nodulaire focale (HNF) vs. adénome hépatocellulaire (AH) - par rapport un examen tomodensitométrique avec injection de produit de contraste.
Cette molécule est commercialisée en Europe depuis 2005 et a obtenu son AMM en juillet 2020, disponible uniquement à l’hôpital. Elle est désormais officiellement commercialisée depuis le 06 janvier 2022.
Elle entre, d’après les recommandations de la Haute Autorité de Santé (HAS), dans le cadre d’un examen diagnostique du foie de première intention lorsqu’un diagnostic avec IRM et rehaussement de contraste en phase retardée est nécessaire au même titre que Multihance (acide gadobénique).
SUR LE MÊME THÈME


Des arguments solides pour élargir les applications de l'échographie de contraste
L’exploration des lésions hépatiques focales est le seul domaine où l’échographie de contraste est autorisée aujourd’hui. Pourtant, des applications non autorisées peuvent apporter un vrai bénéfice au patient. Dans un article publié dans la Revue European Radiology, des experts évoquent des indicati...
28/01/2026 -


Dépistage du carcinome hépatocellulaire : les recommandations de l'AASLD v2023 montrent leur supériotité
L’échographie fait preuve d’une faible sensibilité pour le dépistage du carcinome hépatocellulaire. De nouvelles recommandations de l'American Association for the Study of Liver Diseases (AASLD) sont parues en 2023. Elles ont été comparées à deux autres systèmes d’évaluation couramment utilisés. Ce...
23/01/2026 -


Un modèle d'autosegmentation testé pour prédire la classification de Lauren du cancer gastrique à partir de la TDM
Se servir de la radiomique pour prédire la classification de Lauren pré-opératoire du cancer gastrique à partir d’images de tomodensitométrie est pertinent mais chronophage. Un modèle d’autosegmentation a été testé dans une étude récente publiée dans la Revue European Radiology et a obtenu des résul...
30/12/2025 -


Un modèle de deep learning pour mieux détecter les néoplasies gastriques par TDM
Un nombre significatif de néoplasies gastriques passent inaperçues lors des examens TDM de routine, pour lesquels la segmentation par IA pourrait servir de second lecteur. Des chercheurs chinois ont décrit, dans la Revue Radiology, une approche dédiée basée sur le deep learning qu’ils ont développée...
26/12/2025 -
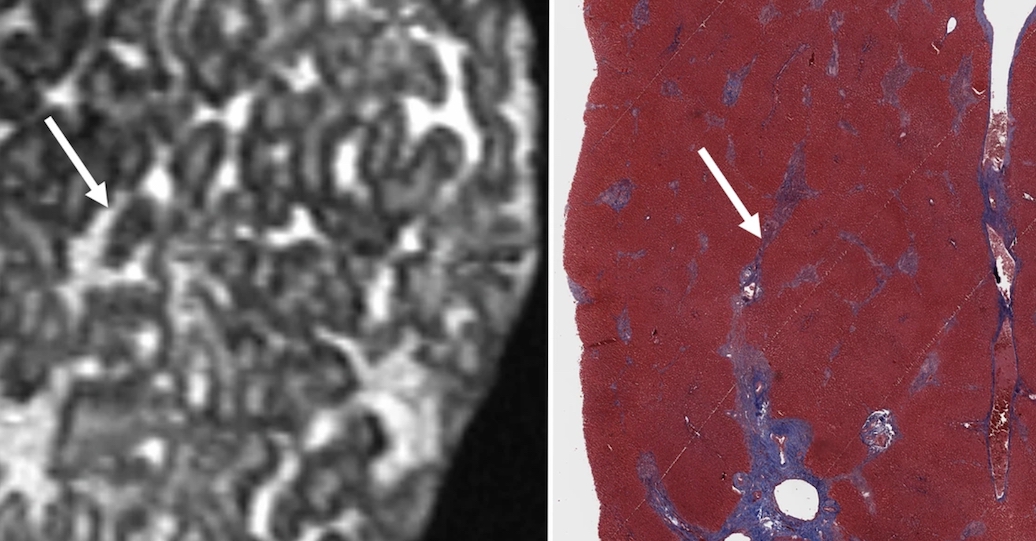

L'IRM 7T comme alternative à l'histopathologie pour l'étude de la fibrose hépatique ex vivo
L’IRM haut champ pourrait potentiellement servir à l’exploration de la fibrose hépatique ex vivo. Une étude française publiée dans la Revue European Radiology compare un échantillon hépatique étudié par histopathologie et par IRM 7T. Les résultats sont jugés comparables et montrent la pertinence de...
12/12/2025 -


L'IRM abdominale en respiration libre évolue encore en pédiatrie
Les techniques d’acquisition IRM abdominale évoluent significativement pour éviter de sédater les enfants. Une étude allemande publiée dans la Revue European Radiology compare des séquences T1w radiales dynamiques en respiration libre à un protocole conventionnel dynamique avec injection. Cette tech...
10/12/2025 -


Des chercheurs américains découvrent un biomarqueur TDM du stress chronique
Grâce à un modèle de deep learning qui identifie un indice de volume surrénalien en tomodensitométrie, des chercheurs ont identifié un biomarqueur inédit du stress chronique. Ils présenteront leur étude lors du congrès annuel de la Radiological Society of North America (RSNA).
28/11/2025 -
LETTRE D'INFORMATION
Ne manquez aucune actualité en imagerie médicale et radiologie !
Inscrivez-vous à notre lettre d’information hebdomadaire pour recevoir les dernières actualités, agendas de congrès, et restez informé des avancées et innovations dans le domaine.


