Vaccination intra-tumorale au NBTXR3: bientôt le marquage CE ?
La nouvelle étude internationale évaluant l'impact du NBTXR3 dans la radiothérapie du sarcome des tissus mous permet de fonder de gros espoirs pour les patients. Le taux de réponse à cette molécule est très significatif et les effets secondaires rares. Nanobiotix est très confiant pour le marquage CE de cette molécule.
Nanobiotix a annoncé, le 21 juin 2018, les résultats positifs de l'étude act.in.sarc de Phase II / III évaluant les effets du NBTXR3 dans le sarcome des tissus mous (STM).
Évaluer l'impact de NBTXR3 pour la radiothérapie du sarcome du tissu mou
"Les données sont exceptionnelles et montrent sans aucun doute une amélioration de l'impact de la radiothérapie avec un nombre de réponses complètes, révèle le Pr. Sylvie Bonvalot, Chef du Service de chirurgie tumorale complexe à l'Institut Curie, à Paris et chercheur principal de l'étude PII / III. NBTXR3 peut apporter de réels avantages aux patients et changer les standards de soins. Cette innovation va jouer un rôle dans de nombreuses autres indications et particulièrement là où la radiothérapie est utilisée seule. NBTXR3 a un nouveau mode d'action qui détruit physiquement les cellules cancéreuses lorsqu'il est activé par radiothérapie. Cette molécule est conçue pour détruire directement les tumeurs et activer le système immunitaire, au niveau local ou pour le traitement systémique des maladies".
L'étude de phase II / III était une étude prospective, randomisée, multinationale, qui a inclus plus de 180 patients atteints de STM localement avancé. L'objectif cette étude était d'évaluer l'efficacité et la tolérance de NBTXR3 activé par radiothérapie par rapport à la radiothérapie seule. Les patients ont été traités avec une dose standard de rayonnement (25 x 2 Gy) et les critères d'efficacité ont été mesurés sur des tumeurs réséquées chirurgicalement.
Un taux de réponse significatif et des marges chirurgicales propres
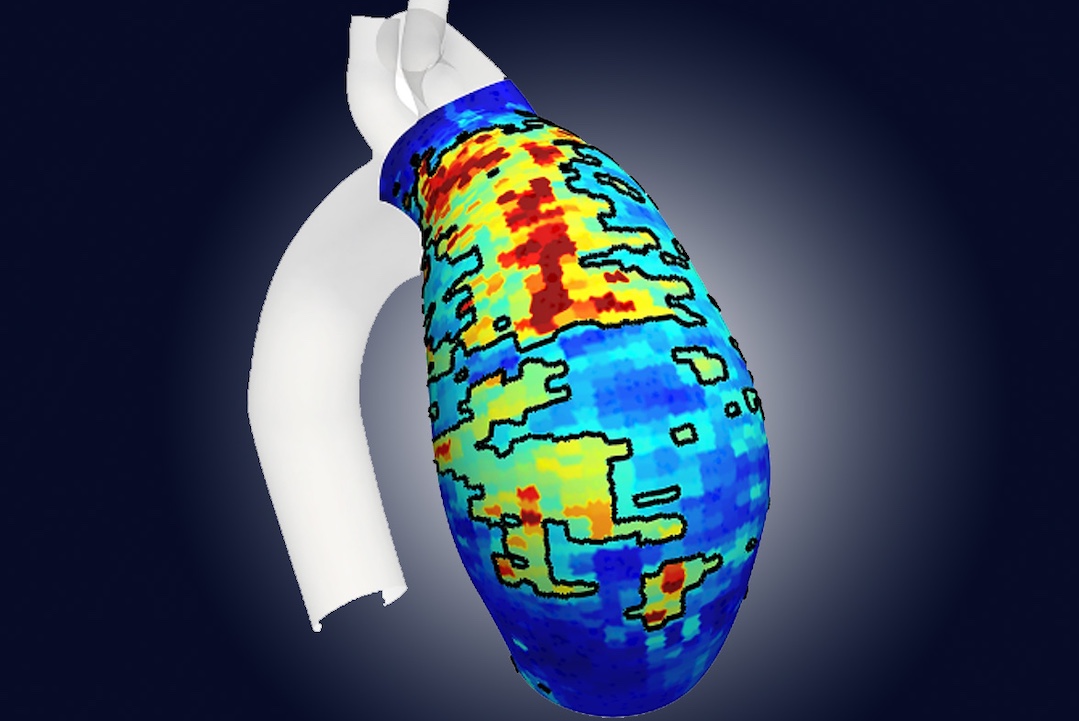
 Le critère d'évaluation principal est le taux de réponse complète pathologique, défini comme le taux de patients présentant moins de 5% de cellules cancéreuses viables résiduelles dans la tumeur après le traitement. Ce critère principal est lié au mode d'action de NBTXR3 et à l'efficacité du produit. Ainsi, deux fois plus de patients (16,1% vs 7,9%) ont fait l'objet d'une réponse complète avec NBTXR3 par rapport à la population témoin (p = 0,0448). La différence significative observée entre les deux populations valide la supériorité du traitement avec NBTXR3 sur la radiothérapie seule.
Le critère d'évaluation principal est le taux de réponse complète pathologique, défini comme le taux de patients présentant moins de 5% de cellules cancéreuses viables résiduelles dans la tumeur après le traitement. Ce critère principal est lié au mode d'action de NBTXR3 et à l'efficacité du produit. Ainsi, deux fois plus de patients (16,1% vs 7,9%) ont fait l'objet d'une réponse complète avec NBTXR3 par rapport à la population témoin (p = 0,0448). La différence significative observée entre les deux populations valide la supériorité du traitement avec NBTXR3 sur la radiothérapie seule.
Le critère secondaire principal est l'état de la marge de résection évaluant la qualité de la chirurgie. L'objectif principal est d'obtenir des marges propres, c'est-à-dire qu'il n'y a plus de cellules cancéreuses trouvées dans les marges chirurgicales. NBTXR3 a démontré une augmentation statistiquement significative du taux de marge chirurgicale, comparé à la radiothérapie seule (augmentation relative de 20%, p = 0,042). "Je suis étonné par la différence de taux de réponse, remarque le Pr Jean-Yves Blay, Directeur du Centre Léon Bérard, à Lyon. Il est extrêmement rare de doubler le taux de réponse histologique complète et je ne vois aucune autre stratégie capable d'accomplir cela. Encore plus impressionnant est le taux de marges propres, qui est augmenté de plus de 20% par rapport à un taux moyen de 64%. Cette différence est vraiment impressionnante, étant donné que cela impacte sur les rechutes et la survie des patients."
Des effets indésirables rares pour un produit au profil universel
NBTXR3 a démontré une bonne tolérance locale parmi ces patients, avec une sécurité liée aux rayonnements équivalente dans les deux populations. Des réactions immunitaires aigües de courte durée ont été observées chez 7,9% des patients et le site d'injection a provoqué des douleurs chez 13,5% des patients. En outre, 6,7% d'entre eux ont fait l'objet d'un hématome / ecchymose de grade 1. En ce qui concerne la toxicité à long terme, des événements indésirables moins graves ont été signalés pour les patients sous NBTXR3.
Les résultats positifs de cette étude confirment et valident encore mieux la demande de marquage CE déposée précédemment pour les sarcomes des tissus mous. La validation clinique du mode d'action physique de NBTXR3 dans une maladie très hétérogène et difficile à traiter renforce le profil universel du produit et confirme la stratégie de développement dans plusieurs indications. Actuellement, la société évalue NBTXR3 dans sept essais cliniques portant sur les cancers de la tête et du cou et dans des programmes d'immuno-oncologie.
SUR LE MÊME THÈME

Le dispositif echOpen consacré par le PRix Galien 2025
Le prix Galien France célèbre l’excellence thérapeutique, reconnu par les pouvoirs publics, récompense l’innovation en santé sous toutes ses formes depuis 1970. L’édition 2025 vient d’être remportée par echOpen, créateur d’une sonde d’échographie clinique ultraportable.
12/12/2025 -

Un éditeur français optimise les processus d'interprétation radiologique
La société française Gleamer a annoncé, le 2 Décembre 2025, le lancement de deux nouvelles solutions technologiques majeures destinées à fluidifier les processus d’interprétation radiologique.
10/12/2025 -

La medtech radiologique française crée l'événement au prochain congrès de la RSNA
À quelques jours de l’ouverture du congrès de la Radiological Society of North America (RSNA), qui se tiendra du 30 Novembre au 4 Décembre 2025, la Société Française de Radiologie (SFR) annonce l’organisation d’un événement exceptionnel, en partenariat avec le Consulat général de France à Chicago et...
20/11/2025 -


Le projet PIMENT fait le point un an après son lancement au CHU de Nantes
Le programme PIMENT mis en place pour l’imagerie du GHT44 avec Siemens Healthineers, célèbre son premier anniversaire. Il a fait l’objet de plusieurs installations d’équipements et fait la part belle à l’innovation au travers du projet de laboratoire LIMAO.
19/11/2025 -


Deux jeunes chercheurs en imagerie témoignent du rôle du mécénat dans leurs travaux
Pour la Journée internationale de la radiologie, nous avons rencontré deux jeunes chercheurs français spécialisés en radiologie. L’un travaille sur un agent de contraste en IRM pour de l’imagerie du système immunitaire, l’autre pour améliorer la précision de la biopsie virtuelle en oncologie grâce à...
17/11/2025 -

Une nouvelle modalité de TDM en charge promue par un constructeur finlandais finlandais
Planmed XFI, dernier-né de la gamme de modalités de (TDM) à faisceau conique (CBCT) est capable de réaliser des scanners corps entier en charge. Cette modalité est sur le point d’être commercialisée aux USA et sera présentée aux prochain congrès RSNA.
15/10/2025 -


Les capacités quantitatives de la TDM à comptage photonique semblent stables à long terme
La tomodensitométrie à comptage photonique allie haute résolution et réduction de l’irradiation, tout en fournissant des images monoénergétiques. Mais la stabilité des données quantitatives issues d’une modalité de TDMCP n’a pas encore été démontrée. C’est ce à quoi s’est attachée une étude publiée...
24/06/2025 -
LETTRE D'INFORMATION
Ne manquez aucune actualité en imagerie médicale et radiologie !
Inscrivez-vous à notre lettre d’information hebdomadaire pour recevoir les dernières actualités, agendas de congrès, et restez informé des avancées et innovations dans le domaine.