Gadolinium: premières mesures de précaution des autorités européennes
Quatre produits de contraste à base de gadolinium linéaire viennent d’être épinglés par l’European Medicines Agency (EMA). Leur autorisation de mise sur le marché fait désormais l’objet d’une recommandation de suspension, les fabricants ayant la possibilité de demander un nouvel examen de la Commission ou de prouver la sécurité de leur produit.
Les instances européennes d’évaluation médicamenteuse ont rendu, le 10 mars 2017, un premier avis concernant la dangerosité des produits de contraste à base de gadolinium linéaire.
Quatre agents de contraste faisant l’objet de recommandations de suspension
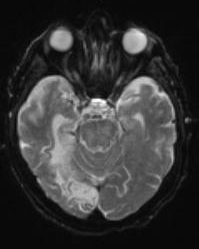 Le Comité de pharmacovigilance et d'évaluation des risques (PRAC) de l’European Medicines Agency (EMA) a recommandé la suspension des autorisations de mise sur le marché de quatre agents de contraste à base de gadolinium linéaire, suite aux différentes observations identifiant de petites quantités de gadolinium dans le cerveau. Ces suspensions pourraient être levées si les fabricants concernées apportent la preuve de nouveaux avantages, dans un groupe de patients identifiés, qui l'emportent sur les risques ou montrent que leur produit, modifié ou non, n’est pas retenu dans les tissus.
Le Comité de pharmacovigilance et d'évaluation des risques (PRAC) de l’European Medicines Agency (EMA) a recommandé la suspension des autorisations de mise sur le marché de quatre agents de contraste à base de gadolinium linéaire, suite aux différentes observations identifiant de petites quantités de gadolinium dans le cerveau. Ces suspensions pourraient être levées si les fabricants concernées apportent la preuve de nouveaux avantages, dans un groupe de patients identifiés, qui l'emportent sur les risques ou montrent que leur produit, modifié ou non, n’est pas retenu dans les tissus.
Une décision motivée par les résultats de plusieurs études
Les agents concernés sont l’acide gadobénique (Multihance), le gadodiamide (Omniscan), l’acide gadopentétique (Magnevist) et le gadoversetamide (OptiMARK), qui font office de produit de contraste en l'imagerie par résonance magnétique (IRM). Les recherches menées par le PRAC sur les agents au gadolinium a montré des preuves convaincantes de l'accumulation de cette substance dans le cerveau, à partir d'études mesurant directement le gadolinium dans les tissus cérébraux et les zones d'intensité de signal plus élevée observées sur les images IRM plusieurs mois après la dernière injection d'un agent de contraste gadolinium.
Une décision répondant au principe de précaution
Selon les procédures en vigueur, les sociétés concernées par ce réexamen ont le droit de demander au PRAC de réexaminer ses recommandations. Les recommandations finales du PRAC seront ensuite transmises au Comité des médicaments à usage humain (CHMP) pour avis. Bien qu'aucun symptôme ou maladie liée au gadolinium dans le cerveau n'a été signalé, le PRAC a pris une décision répondant au principe de précaution, notant que les données sur les effets à long terme dans le cerveau sont limitées. De nombreuses études scientifiques à grande échelle sont toutefois en cours et devraient lui permettre d’avancer sur cette thématique.
Le gadolinium microlitique non concerné par la procédure
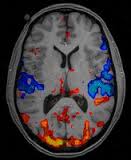 Les quatre agents recommandés pour la suspension sont appelés agents linéaires. Les agents linéaires ont une architecture plus susceptible de libérer du gadolinium, qui peut s'accumuler dans les tissus. D'autres agents, appelés agents macrocycliques, sont plus stables et ont une propension beaucoup plus faible à libérer le gadolinium. Le PRAC recommande que les agents macrocycliques soient utilisés à dose la plus faible pour un contraste suffisant à de bons diagnostics et seulement lorsque les examens non injectés ne suffisent pas.
Les quatre agents recommandés pour la suspension sont appelés agents linéaires. Les agents linéaires ont une architecture plus susceptible de libérer du gadolinium, qui peut s'accumuler dans les tissus. D'autres agents, appelés agents macrocycliques, sont plus stables et ont une propension beaucoup plus faible à libérer le gadolinium. Le PRAC recommande que les agents macrocycliques soient utilisés à dose la plus faible pour un contraste suffisant à de bons diagnostics et seulement lorsque les examens non injectés ne suffisent pas.
Deux substances linéaires bénéficient d’une dérogation
Certains agents linéaires restent disponibles: l'acide gadoxétique (Primovist - Eovist), un agent linéaire utilisé à faible dose pour les examens du foie, peut rester sur le marché car il répond à un besoin diagnostique important chez les patients, avec peu d'alternative. En outre, une formulation d'acide gadopentétique injectée directement dans les articulations peut rester disponible car sa concentration en gadolinium est très faible - environ 200 fois inférieure à celle des produits intraveineux. Ces deux agents, précise une nouvelle fois le PRAC, doivent être utilisés à dose la plus faible pour améliorer les diagnostics par contraste et seulement si les examens non injectés ne conviennent pas.
SUR LE MÊME THÈME


L'IRM prouve l'efficacité de l'acupuncture pour traiter le syndrome post-traumatique crânien
L’acupuncture représente une alternative non médicamenteuse pour traiter le syndrome post-commotionnel chronique. Une étude publiée dans la Revue Radiology prouve son efficacité en utilisant l’IRM par tenseur de diffusion pour évaluer les évolutions des lésions axonales notamment dans ce contexte.
20/08/2025 -

Les inscriptions au 2025 RSNA Intracranial Aneurysm Detection Challenge sont ouvertes !
Comme elle le fait depuis quelques années à l’approche de son congrès annuel, la Radiological Society of North America (RSNA) lance un nouveau challenge faisant intervenir l’IA. Il s’agit du RSNA Intracranial Aneurysm Detection AI Challenge 2025.
13/08/2025 -


Un riche catalogue de biomarqueurs dédiés au TEP pour les maladies neurologiques
L’identification des pathologies cérébrales nécessite désormais une approche biologique en plus de la clinique. Dans ce cadre, des marqueurs spécifiques au TEP permettent la découverte de certaines maladies neurologiques avant toute apparition clinique. Une revue de la littérature publiée dans le Jo...
15/07/2025 -

Une fondation dédiée au développement de l'échothérapie par ultrasons focalisés
Les procédure d’échothérapie par ultrasons focalisés (Focused Ultrasound – FUS) se diversifient, bien que cette activité thérapeutique soit encore à la marge. Mais la Focused Ultrasound Foundation se place parmi les institutions dédiées à son développement.
09/07/2025 -


La stimulation électrique transcrânienne pour améliorer les performances cognitives des patients Alzheimer
Les implications fonctionnelles de la stimulation électrique pour réduire les effets de la maladie d’Alzheimer sont insuffisamment explorées dans la littérature. Une étude publiée dans la Revue Radiology identifie, par IRM fonctionnelle, les apports de la stimulation transcrânienne sur la connectivi...
25/06/2025 -


Optimiser les images de stents intracrâniens par TDM à comptage photonique
Alors que la TDM à comptage photonique est très appréciée, elle est peu présente dans la littérature pour l’exploration des stents intracrâniens. Une étude allemande publiée dans la Revue European Radiology se propose de trouver le meilleur post-traitement de l’angioTDM-CP pour optimiser les images...
11/06/2025 -

Adapter le Segment ANything Model pour l'exploration des hématomes intracrâniens par TDM
Le deep learning est cité en référence pour améliorer l’identification et le volume des hématomes cérébraux. Mais le Segment Anything Model peut gérer les contours complexes ou le faible contraste. Une étude publiée dans la Revue European Radiology expérimente une combinaison du SAM et de paramètres...
02/06/2025 -
LETTRE D'INFORMATION
Ne manquez aucune actualité en imagerie médicale et radiologie !
Inscrivez-vous à notre lettre d’information hebdomadaire pour recevoir les dernières actualités, agendas de congrès, et restez informé des avancées et innovations dans le domaine.


